Tutorial de Química
Ligações químicas e forças atrativas
| Uma molécula é composta por dois ou mais átomos ligados por uma ligação química. As moléculas podem conter diferentes tipos de ligações. Se os átomos estão compartilhando elétrons, a ligação entre eles é covalente. Se um dos átomos doa elétrons para o outro, a ligação entre eles é iônica. |
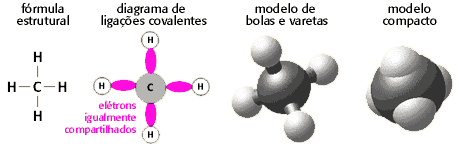
| O metano tem quatro ligações covalentes entre o carbono
(C) e o hidrogênio (H). A figura abaixo mostra a molécula
do metano de quatro maneiras diferentes. Note que em cada uma delas os
átomos e as ligações entre eles estão representadas
de um jeito diferente. A idéia-chave a recordar é que os
átomos envolvidos numa ligação covalente compartilham
elétrons.
|
 |
Átomos podem se ionizar para atingir um número estável de elétrons, perdendo ou ganhando elétrons. Por exemplo, o Na (sódio) pode doar um elétron para o Cl (cloro), gerando os íons Na+ e Cl-. O par iônico é mantido junto por uma forte atração eletrostática. |
Linus Pauling, 1946
- Reatividade química das moléculas - tendência de quebrar e formar ligações químicas.
- Biologia das moléculas - tamanho e forma das moléculas, e natureza das interações fracas com outras moléculas.
- Ligações eletrostáticas (iônicas) - resultam da atração eletrostática entre dois grupos ionizados com cargas opostas, como os grupos carboxila (-COO-) e amino (-NH3+). Em meio aquoso, essas ligações são muito fracas.
- Ligações (ou pontes) de hidrogênio - resultam da atração eletrostática entre um átomo eletronegativo (O ou N) e um átomo de hidrogênio que está ligado covalentemente a um outro átomo eletronegativo:
- Ligações de Van Der Waals - são forças atrativas de curto alcance entre grupos químicos em contato. São provocadas por leves deslocamentos de carga.
- Atrações hidrofóbicas - em meio aquoso, levam à associação entre grupos apolares tais como as cadeias dos hidrocarbonetos.
- Múltiplas ligações ou forças fracas podem ocasionar interações fortes
- O reconhecimento biológico resulta de uma estrutura tridimensional que permita estabelecer múltiplas forças fracas entre moléculas.
N-H ----- O=C- -O-H----- O=C-
 |
The University of Arizona
01 de Janeiro de 2000.
Contact the Development Team
http://www.biology.arizona.edu
All contents copyright © 1997. All rights reserved.