
Lista de Problemas sobre Energia, Enzimas e Catálise
Problema 3: Cinética de uma enzima alostérica.
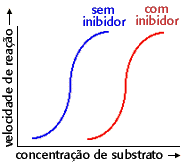
Qual dos gráficos abaixo mostra o comportamento da velocidade de reação em função da concentração do substrato para uma enzima alostérica, em presença e em ausência de um inibidor alostérico?

Enzimas Alostéricas
Enzimas com múltiplas subunidades têm estrutura quarternária. Uma das conseqüências de ter múltiplas subunidades é o fato de que cada subunidade catalítica tem seu próprio sítio ativo. Isso significa que uma enzima com estrutura quarternária pode ligar mais de uma molécula de substrato. Alosteria significa "forma diferente". Enzimas alostéricas mudam de forma entre uma forma ativa e outra inativa como resultado da ligação dos substratos no sítio ativo ou de moléculas regulatórias em outros sítios. No caso mais simples de enzima alostérica com uma forma ativa e uma inativa, a variação da velocidade da reação com o aumento da concentração do substrato é tipicamente uma curva em forma de S. Para mais informações sobre enzimas alostéricas, veja o tutorial da questão 14.Ligação de efetores nas subunidades regulatórias
Enzimas alostéricas também podem ter subunidades regulatórias capazes de ligar moléculas ativadoras ou inibidoras. Ativadores e inibidores são denominados "efetores". Os inibidores fazem com que a enzima alostérica adote a forma inativa. Os ativadores promovem a passagem à forma ativa.Existe um equilíbrio entre as formas ativa e inativa. A quantidade de enzima que está no estado ativo ou inativo depende das concentrações relativas de substrato e inibidor, como sugere o diagrama abaixo:

A ligação do inibidor faz com que a enzima alostérica adote a conformação inativa e promove a ligação cooperativa de uma segunda molécula de inibidor.
Um excesso de substrato pode compensar o efeito do inibidor. A ligação do substrato faz com que a enzima assuma a conformação ativa e promove a ligação cooperativa de outra molécula de substrato, levando à formação do produto.
Significado das curvas em forma de S com e sem inibidor
| A forma da curva sem inibidor está descrita com mais detalhes
no tutorial da questão 14. À medida que a concentração
do substrato é aumentada, o substrato se liga à enzima e
desencadeia a mudança de conformação da enzima para
a forma ativa.
Na presença de inibidor, uma concentração mais elevada de substrato é necessária para mudar a conformação para a forma ativa. Entretanto, uma vez atingida uma concentração de substrato suficientemente alta para promover à passagem à forma ativa, o substrato se liga cooperativamente (daí a curva em forma de S), e atinge-se a mesma velocidade máxima observada sem inibidor. |
 |
The University of Arizona
13 de julho de 2000
Contact the Development Team
http://www.biology.arizona.edu
Copyright © 1996. Todos os direitos reservados.






